背景
光遗传技术是指将光学与遗传学相结合,控制特定蛋白质或者细胞活动的技术。通俗讲就是使用光学手段刺激或抑制经过基因修改过的细胞[1]。可以通过光遗传技术控制的细胞活动包括刺激或抑制细胞活性、基因表达、细胞间信号交流和细胞迁移。可以通过光遗传技术控制的细胞种类包括神经元、心肌细胞、植物茎细胞和癌细胞等。在此主要讨论神经元细胞的特定功能。
使用传统的电刺激或者其他非光学手段,对于希望研究的神经元细胞种类,无法进行准确的刺激或抑制,限制了相关神经元的研究。使用电刺激研究某种特定的在体(In-Vivo)神经元细胞,需要通过手术切除部分组织,以方便用于精确电刺激的激励电极接入。总之,使用非光遗传手段对在体神经元细胞进行精确控制是非常困难的。随着技术的发展,科学家希望通过光刺激手段对在体神经元细胞进行精确控制。如图 1所示,对特定类型神经元进行光刺激主要分为以下几个步骤:
(1)首先寻找或者建立视蛋白(Opsin)的遗传基因;
(2)将视蛋白的遗传基因转录进入所感兴趣种类神经元细胞的遗传基因中;
(3)对经过视蛋白基因改造后的神经元细胞进行培养,使其表达出可用于光刺激的神经元细胞;
(4)使用光学手段对含有视蛋白的在体神经元细胞进行精确光刺激;
(5)观察并记录在精确光刺激下含有视蛋白神经元细胞的活动,用于深入研究所感兴趣神经元的特性。

图 1 光刺激神经元细胞流程[2]
视蛋白
众多光敏离子通道蛋白中,离子通道视紫红质蛋白(Channelrhodopsin,ChR2)是一种常用的可用于光开关的光敏蛋白。ChR2最早由Nagel课题组发现[3],并通过蓝光精确控制。ChR2激励波段为蓝光波段,虽然光毒性相对较高,但是由于蓝光波长相对较短,其激励精确度相对较高,光敏蛋白所需阈值激励光功率较低。由于ChR2本身不含有荧光体,所以还需要通过转录的方法对其质粒(Plasmid)进行转录以引入荧光体,方便后续的荧光成像实验观察。对于现有的光敏蛋白还需要进行不断的诱导变异,使其具有更适用于光遗传技术的特性,具体发展方向包括更高传导性的蛋白质离子通道、更高的视蛋白光灵敏度、更低的激励光激活阈值、激励光敏感频谱适度红移、更快的视蛋白离子通道响应速度、更明显的相应形式以及更高的光电流产生效率。
当完成对视蛋白的选择与培育后,需要将含有这种视蛋白基因的质粒传送至目标细胞中,要求这种细胞含有荧光体,提便于后期的荧光成像实验观察。
光刺激
为了观察一定深度脑组织的荧光成像,需要通过光纤向含有视蛋白的神经元传输激励光,同时收集荧光信号,收集到的荧光信号在经过二向色镜(DM)和带通滤光片(BP)滤光降噪后由光电探测器(APD or PMT)收集,用于成像观察。
一般选用老鼠作为实验对象。当观察较浅深度脑组织中含有视蛋白的神经元时,可以去除一部分老鼠头盖骨,将共聚焦(Confocal)或多光子(Multiphoton)的微型化探头安装在老鼠头上,以对老鼠脑部中含有视蛋白的神经元进行在体光刺激同时通过荧光成像观察。其工作结构示意图如图2所示。

图 2 鼠脑神经元光刺激结构示意图[2]
为了实现对含有视蛋白的神经元进行精准刺激,需要对激励光脉冲进行时域控制,具体包括脉冲宽度、脉冲时间间隔和脉冲重复率的控制。可以通过编写特定的驱动程序以使激光器输出所需形式的激励光,还可以通过激励光光路上外加电控快门(Shutter)控制激励光的输出形式。输入激励光的光强可以通过调节激光器的驱动电流、调节起偏器偏振角度或者通过引入声光调节器等方法进行调节。
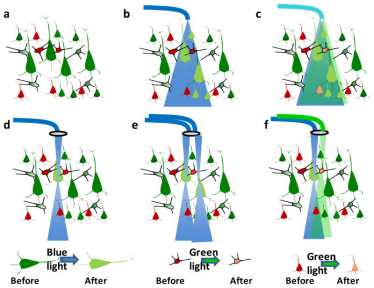
图 3 光刺激含有视蛋白神经元示意图[2]
如图3所示列举了几种常见的光刺激。以ChR2和C1V1两种常用的视蛋白和相应的蓝色和绿色激励光为例,图3列举几种常见的光刺激方法,其中图a为在没有激励光照射下含有ChR2和C1V1两种视蛋白的神经元;图b表示使用蓝色激励光对一片含有ChR2视蛋白的神经元进行刺激的光刺激方法,用于对研究一片神经元的细胞特性;图c表示同时使用蓝色和绿色激励光,对一片含有ChR2和C1V1两种视蛋白的神经元进行激励,用于研究两种视蛋白神经元共同刺激时的神经网络工作特性;图d为将一种激励光进行聚焦,用于精确对某一位置含有视蛋白的神经元进行光刺激,以研究在单个神经元受到刺激时,神经系统的工作特性,相对而言图e、图f分别表示使用相同或不同波段激励光同时对不同位置神经元进行精确激励,研究不同神经元个体同时受到激励时,神经网络的工作情况。总之,应该根据不同的应用环境选择合适的光刺激方法对神经元进行刺激,以得到最佳的实验条件。
参考文献
[1] Deisseroth, Karl. Optogenetics: 10 years of microbial opsins in neuroscience[J]. Nature Neuroscience, 2015, 18(9):1213-1225.
[2] Mohanty, Samarendra K, Lakshminarayananan, Vasudevan. Optical techniques in optogenetics[J]. Journal of Modern Optics, 62(12):949-970.
[3] Nagel G, Szellas T, Huhn W, Kateriya S, Adeishvili N, Berthold P, Ollig D, Hegemann P, Bamberg E. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc Natl Acad Sci U S A. 2003;100(24):13940–13945.



